1)脳動脈瘤研究の社会的重要性(なぜ脳動脈瘤研究を行うのか)
脳動脈瘤は脳血管分岐部に発生する嚢状の病変であり、くも膜下出血の主要な原因疾患となっている。脳動脈瘤は認知度の高い疾患ではないが、実際は一般人口の3~5%に存在する頻度の高い疾患である。近年では、脳ドックの際に発見されることも多くなってきている。医療技術の発達した現在でなお致死率50%に至る予後の悪いくも膜下出血の発症を予防するためには、未破裂の状態で発見される脳動脈瘤に対して破裂予防を目指した先制医療としての治療介入が必須である。しかし、治療法には外科治療しか存在せず、未だに脳動脈瘤の進展を抑制する有効な薬物治療法は開発されていない。そのため、脳動脈瘤の病態形成機構を明らかとし、新規の治療法や診断法を開発することは社会的急務である。
2)現在までの我々の研究成果
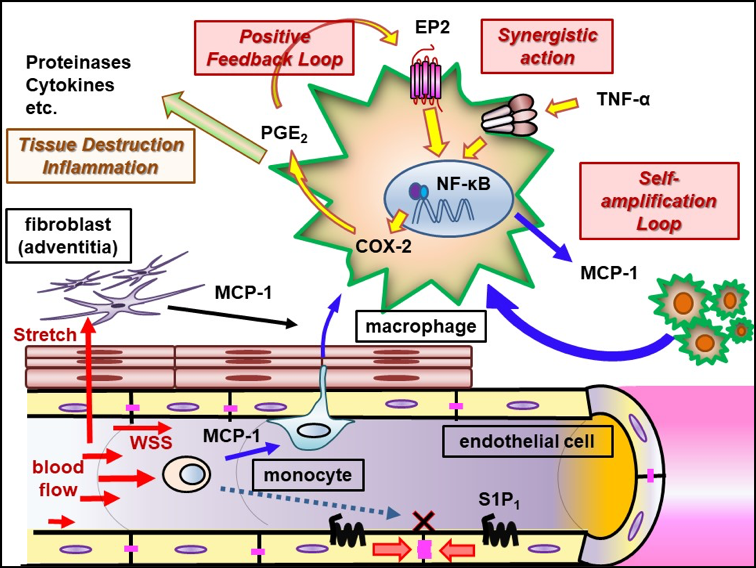
当グループでは、脳動脈瘤を高率に発生する動物モデルを用い、それに遺伝子組み換え動物を供したり各種特異的薬物を使用することにより、脳動脈瘤の形成および増大機構の解析を行ってきた。その結果、①脳動脈瘤発生では高いずり応力と伸展張力といった血流による力学的刺激が誘因となること、②脳動脈瘤発生増大に血管壁の慢性炎症反応が関与する事、③炎症反応ではマクロファージが重要であること、④マクロファージ内でプロスタグランジン経路の誘導やNF-B活性化による炎症の慢性化機構が機能している、⑤それら炎症反応を担う分子に対しての特異的薬物により瘤発生増大の予防効果が認められる事を世界に先駆け報告した。そして、「脳動脈瘤は脳血管壁のマクロファージ依存的慢性炎症性疾患である」という現在広く認められる疾患概念を提唱した。さらに臨床応用の観点では、スタチン製剤の脳動脈瘤破裂予防効果を検証する観察研究を実施し、世界に先駆けてくも膜下出血発症予防のための薬物治療法開発の可能性を示した。
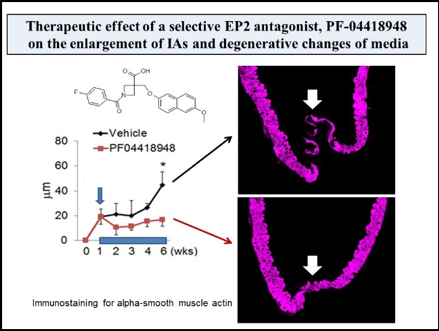
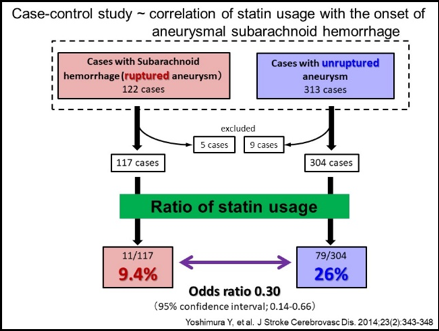
これら我々の研究により脳動脈瘤病態形成機構の一端が解明されくも膜下出血予防のための薬物治療の可能性が示されたことは下記のように大きく報道された。我々は、さらに次項で示すような研究を進めることでくも膜下出血の無い社会の実現を目指している。

3)現在の研究テーマ
① 脳動脈瘤破裂機構の解析
最近になり我々は既存の脳動脈瘤モデル動物を改変することで、高率に瘤の自然破裂によるくも膜下出血発症を再現可能なモデル動物を新規に樹立することに成功し報告した。よって、脳動脈瘤の発生から破裂までの病態の全過程を再現可能な動物実験系を確立した。特に脳動脈瘤の破裂機構については現在まで不明な点が多い一方で、破裂によるくも膜下出血を予防することこそ脳動脈瘤治療の根幹をなすことであるために、我々は本モデル動物を使用し破裂機構の解析を行っている。そして、このモデル動物を使用することで脳動脈瘤の破裂に至る誘因として、血管壁でのVasa vasorumの誘導とそれを介した炎症細胞浸潤の重要性を示唆するデータを得た。本モデル動物での破裂機構をさらに詳細に解析することで、破裂機構を解明しそれを担う分子群を創薬標的として同定することを目指している。
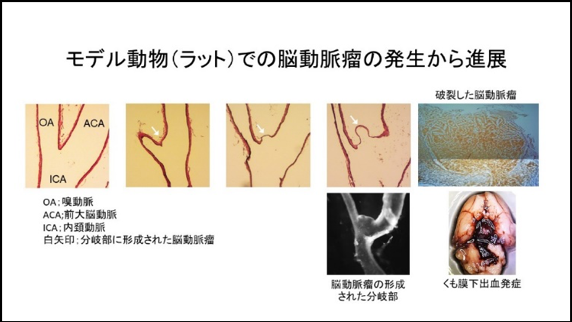
② 脳動脈瘤に対する薬物治療法開発
上述のモデル動物の開発により、脳動脈瘤の発生から増大そして破裂に至る全過程につきモデル動物で再現することが可能となった。よって、すでに炎症関連因子を中心にいくつかの創薬標的を同定しているため、臨床開発に向けそれらの標的に対する特異的薬物の治療薬としての可能性をモデル動物を用い検証する。さらに、今後新規に同定する薬物についても脳動脈瘤の増大や破裂に対する薬効を検証する。
③ マクロファージを標的とした破裂危険性推定のための新規診断法開発
脳動脈瘤の年間の平均破裂率が1%と高くないことや、現状の治療法が外科治療しかないことを考え合わせると、真に破裂率が高いと推測される病変のみを適切にピックアップして治療介入対象として選別することが重要である。しかし、現在のところ脳動脈瘤の破裂率推定の方法は不十分であり、未治療の症例での破裂によるくも膜下出血も時折経験する。よって、新規の診断マーカーの開発が必須である。我々はそのような背景を持って、病変内の炎症反応が強く増大や破裂の危険性が高い病変を非侵襲的に選別するための診断法の開発を行っている。その中でFerumoxytolという超磁性体鉄ナノ粒子をマクロファージに貪食させMRIで可視化する臨床研究を実施した。現在はFerumoxytolを用いた臨床研究から得られた課題をもとに、マクロファージイメージング法と呼んでいるMRIで脳動脈瘤壁内のマクロファージの存在を可視化する技術に使用するための新規造影剤の開発を進めている。
④ 脳動脈瘤をモデル疾患とした生体の血流ストレス応答機構の解明
血管病の中でも特に脳動脈瘤では、その病態が血流ストレスの影響を強く受けることが明らかとなりつつある。例えば、脳動脈瘤形成は高いずり応力負荷により誘発され、増大している部位では低いずり応力負荷や乱流が認められる。破裂についても、いまだ議論は残るが乱流が重要であるという報告もなされている。一方で、血流ストレスという力学的な要素がどのように炎症などの生物学的な現象を惹起し病態形成を起こすのかについてはいまだ明らかでない部分が多い。そのために、脳動脈瘤を血流ストレス負荷依存的疾患のモデル疾患として、力学刺激がどのように炎症反応という生物学的反応に転換され病態形成を担うのかという普遍的命題の解明を目指している。
参考文献(抜粋)
総説
1. Aoki T#, Miyata H, Abekura Y, Koseki H, Shimizu K. Rat model of intracranial aneurysm. Variations, usefulness and limitations of the Hashimoto Model. Acta Neurochir. Suppl. 2020;127:35-41. # corresponding author
2. Kushamae M, Shimizu K, Aoki T#. Macrophage Imaging of Intracranial Aneurysms. Neurol. Med. Chir. (Tokyo) 2019;59(7):257-263. # corresponding author
3. Shimizu K, Kushamae M, Mizutani T, Aoki T#. Intracranial Aneurysm as a Macrophage-Mediated Inflammatory Disease. Neurol. Med. Chir. (Tokyo) 2019;59(4):126-132. # corresponding author
4. Aoki T, Yamamoto R, Narumiya S. Targeting macrophages to treat intracranial aneurysm. Oncotarget 2017;8(62):104704-104705.
5. Aoki T, Nozaki K. Preemptive medicine for cerebral aneurysm. Neurol. Med. Chir. (Tokyo) 2016;56(9):552-568.
6. Fukuda M, Aoki T#. Molecular basis for the intracranial aneurysm formation. Acta Neurochir. Suppl. 2015;120:13-15. # corresponding author
7. Aoki T#, Fukuda M, Narumiya S. Chronic inflammation in intracranial aneurysm formation. Inf. Reg. 2013;33(5):283-287. # corresponding author
8. Aoki T, Narumiya S. Prostaglandins and chronic inflammation. Trends Pharmacol. Sci. 2012;33(6):304-311.
日本語総説
1. 九社前実香、清水寛平、青木友浩. 脳動脈瘤に対するマクロファージを標的とした新規薬物治療法開発の可能性. The 37th Meeting of The Mt. Fuji Workshop on CVD 2019;37:37-41.
2. 青木友浩. 脳血管の慢性炎症性疾患としての脳動脈瘤の理解と薬物治療法開発への展望. 循環器病研究の進歩 2018;19(1):66-74.
3. 青木友浩. 脳動脈瘤に対する新規薬物治療法・診断法開発の可能性と近未来展望. 脳神経外科ジャーナル 2018;27(12):882-888.
4. 青木友浩、小関宏和、宮田悠、安部倉友、清水寛平. 炎症を通し脳動脈瘤を理解する. 脳神経外科 2018;46(4):275-294.
5. 青木友浩. 脳動脈瘤治療のパラダイムシフト. The 35th Meeting of The Mt. Fuji Workshop on CVD 2017;35:1-9.
6. 青木友浩. 脳動脈瘤形成機序の解明に基づく新規薬物治療法開発への展望. 日本薬理学雑誌 2016;148(2):86-91.
7. 青木友浩、成宮周. なぜ炎症は慢性化するのか?―プロスタグランジンからみて―. 炎症と免疫 2012;20(6);535-540.
8. 青木友浩. 血流と脳動脈瘤形成. 細胞 2011;43(9):326-329.
9. 青木友浩、野崎和彦. 脳動脈瘤予防とスタチン. 脳神経外科速報 2011;21(1):64-71.
10.青木友浩、西村真樹、野崎和彦. 脳動脈瘤形成の分子生物学~脳動脈瘤研究の最新の知見~ 脳神経外科速報 2009;19(1):60-67.
著書
1. 青木友浩. 脳血管疾患の遺伝子異常の検索の意義. 脳神経外科周術期管理のすべて(改訂第5版)(松谷 雅生・田村 晃・藤巻高光・森田明夫監修), メジカルビュー社 (東京), p. 160-168 (2019)
2. 野崎和彦、青木友浩. 脳動脈瘤の発生と破裂の分子生物学的メカニズム. プライム脳神経外科 (木内博之・斉藤延人 監修、木内博之 編集), 三輪書店 (東京), p. 5-11 (2017)
3. 小関宏和、宮田悠、青木友浩. 脳動脈瘤新生モデル(京都モデル), 完全版脳血管内治療学 (滝和郎監修、宮地茂・松丸祐司・田中美千裕編集), メディカ出版 (大阪), p. 305-307 (2018)
4. Aoki T, Yamamoto K. Fundamentals of Physiology and Biology of Vascular System. In Vascular Engineering (eds., Tanishita K. & Yamamoto K.), Springer Nature, Switzerland, p. 47-68 (2016)
5. Aoki T, Narumiya S. Prostaglandins in chronic inflammation. In Chronic Inflammation: Elucidation and Control of the Mechanisms, (eds., Takatsu K. & Miyasaka M.), Springer Nature, Switzerland, p. 3-17 (2016)
6. 青木友浩. 脳動脈瘤の基礎研究. 未破裂脳動脈瘤 Japan Standard (嘉山孝正監修、井川房夫・森田明夫編集), 中外医学社 (東京) p. 31-39, (2015)
7. 青木友浩. 脳血管疾患の遺伝子異常の検索の意義. 脳神経外科周術期管理のすべて(改訂第4版)(松谷 雅生・田村 晃・藤巻高光・森田明夫監修), メジカルビュー社 (東京), p. 153-161 (2014)
8. 青木友浩. 脳動脈瘤形成機序の最新の知見と脳動脈瘤治療法変革への展望. 先端医療シリーズ45「臨床医のための最新脳神経外科」 (橋本信夫・寺本 明・小川 彰・嘉山孝正監修), (株)寺田国際事務所/先端医療技術研究所 (東京), p. 179-183 (2014)
9. 青木友浩、野崎和彦. 未破裂脳動脈瘤に対する薬物治療. 神経疾患最新の治療 2012-2014 (小林祥泰・水澤英洋ら監修), 南江堂 (東京), p. 6-9 (2012)
原著
1. Koseki H, Miyata H, Shimo S, Ohno N, Mifune K, Shimano K, Yamamoto K, Nozaki K, Kasuya H, Narumiya S, Aoki T#. Two diverse hemodynamic forces, a mechanical stretch and a high wall shear stress, determine intracranial aneurysm formation. Transl. Stroke Res. in press # corresponding author
2. Shimizu K, Miyata H, Abekura Y, Oka M, Kushamae M, Kawamata T, Mizutani T, Kataoka H, Nozaki K, Miyamoto S, Aoki T#. High fat diet intake promotes the enlargement and degenerative changes in the media of intracranial aneurysms in rats. J. Neuropathol. Exp. Neurol. 2019;78(9):798-807. # corresponding author
3. Miyata H, Imai H, Koseki H, Shimizu K, Abekura Y, Oka M, Kawamata T, Matsuda T, Nozaki K, Narumiya S, Aoki T#. Vasa vasorum formation is associated with rupture of intracranial aneurysms. J. Neurosurg. 2019;16:1-11. # corresponding author
4. Aoki T#, Koseki H, Miyata H, Itoh M, Kawaji H, Takizawa K, Kawashima A, Ujiie H, Higa T, Minamimura K, Kimura T, Kasuya H, Nozaki K, Morita A, Sano H, Narumiya S. RNA sequencing analysis revealed the induction of CCL3 expression in human intracranial aneurysms. Sci. Rep. 2019;9(1):10387. # corresponding author
5. Miyata H, Shimizu K, Koseki H, AbekuraY, Kataoka H, Miyamoto S, Nozaki K, Narumiya S, Aoki T#. Real-Time Imaging of an Experimental Intracranial Aneurysm in Rats. Neurol. Med. Chirur. (Tokyo) 2019;59(1):19-26. # corresponding author
6. Aoki T, Saito M, Koseki H, Tsuji K, Tsuji A, Murata K, Kasuya H, Morita A, Narumiya S, Nozaki K; for MR macrophage imaging study investigators. Macrophage imaging of cerebral aneurysms with ferumoxytol: an exploratory study in an animal model and in patients. J. Stroke Cerebrovasc. Dis. 2017;26(10):2055-2064.
7. Aoki T, Frosen J, Fukuda M, Bando K, Shioi G, Tsuji K, Ollikainen E, Nozaki K, Laakkonen J, Narumiya S. Prostaglandin E2-EP2-NF-kB signaling in macrophages as a potential therapeutic target of intracranial aneurysm. Sci. Signal. 2017;10:eaah6037.
8. Miyata H, Koseki H, Takizawa K, Kasuya H, Nozaki K, Narumiya S, Aoki T#. T cell function is dispensable for intracranial aneurysm formation and progression. PLoS ONE 2017;12(4):e0175421. # corresponding author
9. Yamamoto R, Aoki T, Koseki H, MFukuda M, Hirose J, Tsuji K, Takizawa K, Nakamura S, Miyata H, Hamakawa N, Kasuya H, Nozaki K, Hirayama Y, Aramori I, Narumiya S. An S1P1 agonist, ASP4058, suppresses intracranial aneurysm progression through promoting endothelial integrity and blocking macrophage transmigration. Br. J. Pharmacol. 2017;174(13):2085-2101.
10. Aoki T#, Yamamoto K, Fukuda M, Shimogonya Y, Fukuda S, Narumiya S. Sustained expression of MCP-1 by low wall shear stress loading concomitant with turbulent flow on endothelial cells of intracranial aneurysm. Acta Neuropathol. Commun. 2016;4(1):48. # corresponding author
11. Aoki T#, Fukuda M, Nishimura M, Nozaki K, Narumiya S. Critical role of TNF-alpha-TNFR1 signaling in intracranial aneurysm formation. Acta Neuropathol. Commun. 2014;2:34. # corresponding author
12. Fukuda M, Aoki T, Manabe T, Maekawa A, Shirakawa T, Kataoka H, Takagi Y, Miyamoto S, Narumiya S. Exacerbation of intracranial aneurysm and aortic dissection in hypertensive rat by treatment with a prostaglandin F receptor antagonist, AS604872. J. Pharmacol. Sci. 2014;126(3):230-242.
13. Yoshimura Y, Murakami Y, Saitoh M, Yokoi T, Aoki T, Miura K, Ueshima H, Nozaki K; SSS Research Group Statin Use and Risk of Cerebral Aneurysm Rupture. A Hospital-Based Case-Control Study in Japan. J. Stroke Cerebrovasc. Dis. 2013;23(2):343-348.
14. Aoki T, Kataoka H, Nishimura M, Ishibashi R, Morishita R, Miyamoto S. Regression of intracranial aneurysms by simultaneous inhibition of NF-kB and ets with chimeric decoy oligodeoxynucleotide treatment. Neurosurgery 2012;70(6):1534-1543.
15. Aoki T, Nishimura M, Matsuoka T, Yamamoto K, Furuyashiki T, Kataoka H, Kitaoka S, Ishibashi R, Ishibazawa A, Miyamoto S, Morishita R, Ando J, Hashimoto N, Nozaki K, Narumiya S. PGE2-EP2 signaling in endothelium is activated to hemodynamic stress and induces cerebral aneurysm through an amplifying loop via NF-B. Br. J. Pharmacol. 2011;163(6):1237-1249.
16. Aoki T, Nishimura M, Kataoka H, Ishibashi R, Nozaki K, Miyamoto S. Complementary inhibition of cerebral aneurysm formation by eNOS and nNOS. Lab. Invest. 2011;91(4):619-626.
17. Aoki T, Nishimura M, Kataoka H, Ishibashi R, Takagi Y, Hashimoto N. Toll like receptor 4 expression during cerebral aneurysm formation. J. Neurosurg. 2010;113(8):851-858.
18. Aoki T, Nishimura M, Kataoka H, Ishibashi R, Nozaki K, Hashimoto N. Reactive oxygen species are responsible for cerebral aneurysm formation: study using p47phox-/- mice and the free radical scavenger ‘edaravone’. Lab. Invest. 2009;89(7):730-741.
19. Aoki T, Kataoka H, Ishibashi R, Nozaki K, Morishita R, Hashimoto N. Reduced collagen biosynthesis in cerebral aneurysmal walls is mediated by up-regulated expression of interleukin-1β and the nuclear factor-κB pathway. Arterioscler. Thromb. Vasc. Biol. 2009;29(7):1080-1086.
20. Aoki T, Kataoka H, Ishibashi R, Nakagami H, Nozaki K, Morishita R, Hashimoto N. Pitavastatin suppresses the formation and progression of cerebral aneurysms through the inhibition of nuclear factor kappa B pathway. Neurosurgery 2009;64(2):357-366.
21. Aoki T, Kataoka H, Ishibashi R, Nozaki K, Hashimoto N. Impact of monocyte chemoattractant protein-1 deficiency on cerebral aneurysm formation. Stroke 2009;40(3):942-951.
22. Aoki T, Kataoka H, Ishibashi R, Nozaki K, Hashimoto N. Cathepsin B, K and S are expressed in cerebral aneurysms and promote the progression of cerebral aneurysms Stroke 2008;39(9):2603-2610.
23. Aoki T, Kataoka H, Ishibashi R, Nozaki K, Hashimoto N. Simvastatin suppresses the progression of experimentally induced cerebral aneurysms in rats. Stroke 2008;39(4):1276-1285.
24. Aoki T, Kataoka H, Shimamura M, Nakagami H, Wakayama K, Moriwaki T, Ishibashi R, Nozaki K, Morishita R, Hashimoto N. NF-B is a key mediator of cerebral aneurysm formation. Circulation 2007;116(24):2830-2840.
25. Aoki T, Kataoka H, Moriwaki T, Nozaki K, Hashimoto N. The role of TIMP-1 and TIMP-2 in the progression of cerebral aneurysms. Stroke 2007;38(8):2337-2345.
26. Aoki T, Kataoka H, Morimoto M, Nozaki K, Hashimoto N. Macrophage-derived matrix metalloproteinase-2 and -9 promote the progression of cerebral aneurysms in rats. Stroke 2007;38(1):162-169.
