タンパク質の構造変化を読み解く重要性
私たちの研究室では、X線結晶構造解析およびクライオ電顕による単粒子解析を駆使して、独自に発見した活性調節剤とチトクロムCオキシダーゼの構造解析に取り組み、すでに複数の複合体構造を得ています。これらの成果はチトクロムCオキシダーゼ活性調節の動作原理の解明につながる可能性があります。分子動力学シミュレーションにより、スナップショットである構造解析データに時間軸を加え、分光学的解析手法を組み合わせて、活性調節機構の解明を目指しています。
また化合物との複合体構造解析は、結合部位の同定と結合面の構造情報を得ることにより、合理的な化合物の改良につながります。すなわちより結合特異性が高く、副作用の少ないリード化合物の創出を助け、成功確率をあげる重要な創薬戦略になります。
タンパク質の構造をいかした創薬展開
薬剤耐性菌の脅威に備えることは、世界保健衛生上の最重要課題である。薬剤耐性は抗生剤に耐性の遺伝子変異を獲得することのみならず、エネルギー代謝の多様性や、バイオフィルムの形成による抗生物質の不達、抗菌剤の排出機構など複合的な要素で形成されます。従来の抗菌剤の標的は、細胞壁合成阻害や核酸合成阻害など増殖期に有効ですが、一旦休止期となるような巧妙に生き残る菌を消失させることは困難であり、新規メカニズムによる抗菌剤の開発が強く求められています。呼吸鎖・生体エネルギー産生機構は休止期にも必須の機構ですが、これまで創薬標的とはなってきませんでした。その一番の理由は、エネルギー産生機構は生物に共通の普遍的な機構であり、病原菌だけを特異的に標的とすることができないと考えられてきたからです。
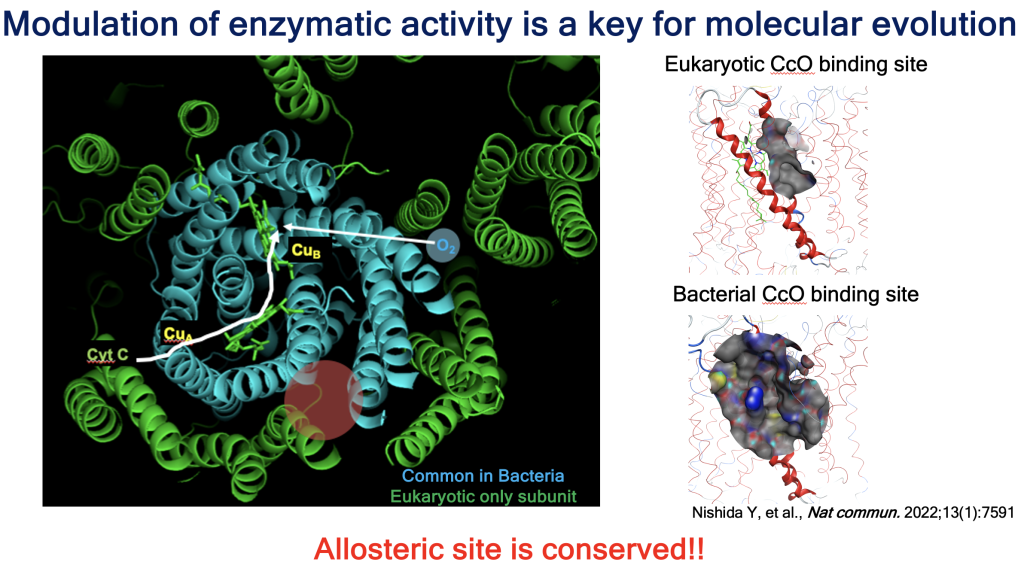
この常識は、膜タンパク質の構造解析が進んだ結果くつがえされるようになっています。ヒトも病原菌も同じ機構(電子伝達と化学浸透共役)で、同じような酵素群を使ってエネルギー産生をおこないます。その酵素のコアの構造は驚くほど保存されています。しかし、真核生物にはコアの外側にサブユニットタンパクを加えて複雑さを増しています。すなわちタンパク質の形が、「似ているが異なる」のです。この構造の違いを利用すれば、病原菌の呼吸鎖・エネルギー産生だけ特異的に阻害する抗菌剤の開発が可能になります。
【参考文献】
1. Nishida Y, et al. Nat. Commun. 2022 Dec 8;13(1):7591.